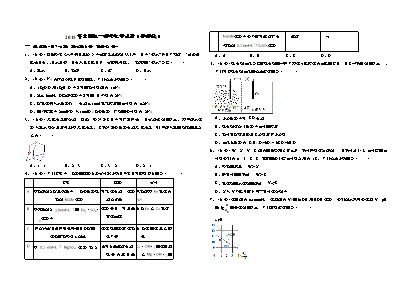
﹣2013年全国统一高考化学试卷(大纲版)B.氯化钠固体与浓硫酸混合加热:H2SO4+2ClSO2↑+Cl2↑+H2O2++﹣3+一、选择题C.磁性氧化铁溶于稀硝酸:3Fe+4H+NO3═3Fe+NO↑+3H2O2﹣2+﹣3+2﹣1.下面有关发泡塑料饭盒的叙述,不正确的是( )D.明矾溶液中滴入Ba(OH)2溶液使SO4恰好完全沉淀:2Ba+3OH+Al+2SO4═A.主要材质是高分子材料B.价廉、质轻、保温性能好2BaSO4↓+Al(OH)3↓C.适用于微波炉加热食品D.不适于盛放含油较多的食品7.如图表示溶液中c(H+)和c(OH﹣)的关系,下列判断错误的是( )2.反应X(g)+Y(g)⇌2Z(g);△H<0,达到平衡时,下列说法正确的是( )A.减小容器体积,平衡向右移动B.加入催化剂,Z的产率增大C.增大c(X),X的转化率增大D.降低温度,Y的转化率增大1218143.下列关于同温同压下的两种气体CO和N2的判断正确的是( )A.体积相等时密度相等B.原子数相等时具有的中子数相等A.两条曲线间任意点均有c(H+)×c(OH﹣)=KwC.体积相等时具有的电子数相等D.质量相等时具有的质子数相等.区域内任意点均有(+)<(﹣)2﹣BMcHcOH4.电解法处理酸性含铬废水(主要含有Cr2O7)时,以铁板作阴、阳极,处理过程中存在反应.图中<2﹣2++3+3+3+CT1T2Cr2O7+6Fe+14H═2Cr+6Fe+7H2O,最后Cr以Cr(OH)3形式除去,下列说法不正确的D.XZ线上任意点均有pH=7是( )8.某单官能团有机化合物,只含碳、氢、氧三种元素,相对分子质量为58,完全燃烧时产生等A.阳极反应为Fe﹣2e﹣═Fe2+物质的量的CO2和H2O.它可能的结构共有(不考虑立体异构)( )B.电解过程中溶液pH不会变化A.4种B.5种C.6种D.7种C.过程中有Fe(OH)3沉淀生成 2﹣D.电路中每转移12mol电子,最多有1molCr2O7被还原二、解答题(共4小题,满分60分)5.下列操作不能达到目的是( )9.(15分)五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同选项目的操作族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和BA.配制100mL1.0mol/LCuSO4溶液将25gCuSO4•5H20溶于100mL蒸馏水中形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.回答下列问题:B.除去KNO3中少量NaCl将混合物制成热的饱和溶液,冷却结晶,过滤(1)五种元素中,原子半径最大的是 ,非金属性最强的是 (填元素符号);.在溶液中将﹣完全转化为2+向酸性溶液中滴加溶液至紫色消失CMnO4MnKMnO4H2O2(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是 (用化学式表D.确定NaCl溶液中是否混有Na2CO3取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊示);A.AB.BC.CD.D(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为 ,其中存在的化6.能正确表示下列反应的离子方程式是( )学键类型为 ;+2﹣A.用过量氨水吸收工业尾气中的SO2:2NH3•H20+SO2═2NH4+SO3+H2O(4)D最高价氧化物的水化物的化学式为 ;第1页(共12页)(5)单质D在充足的单质E中燃烧,反应的化学方程式为 ;D在不充足的E中燃烧,生成的主要产物的化学式为 ;(6)单质E与水反应的离子方程式为 .10.(15分)制备氮化镁的装置示意图如图所示:图2②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如图2所示:回答下列问题:(1)写出反应1的化学方程式 ;(2)滤液Ⅰ中加入CaO生成的沉淀是 ,反应2的离子方程式为 ;(3)E可作为建筑材料,化合物C是 ,写出由D制备冰晶石的化学方程式 ;(4)电解制铝的化学方程式是 ,以石墨为电极,阳极产生的混合气体的成分是 .12.(15分)芳香化合物A是一种基本化工原料,可以从煤和石油中得到.OPA是一种重要的回答下列问题:有机化工中间体.A、B、C、D、E、F和OPA的转化关系如下所示:(1)检查装置气密性的方法是 ,a的名称是 ,b的名称是 ;(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式 ;(3)C的作用是 ,D的作用是 ,是否可以把C和D的位置对调并说明理由 ;(4)写出E中发生反应的化学方程式 ;(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现回答下列问题:象 .(1)A的化学名称是 ;11.(15分)铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制(2)由A生成B的反应类型是 .在该反应的副产物中,与B互为同分异构体的化合物得.的结构简式为 ;①铝土矿的主要成分是Al2O3和SiO2等.从铝土矿中提炼Al2O3的流程如图1所示:(3)写出C所有可能的结构简式 ;(4)D(邻苯二甲酸二乙酯)是一种增塑剂.请用A、不超过两个碳的有机物及合适的无机试剂为原料,经两步反应合成D.用化学方程式表示合成路线 ;(5)OPA的化学名称是 ,OPA经中间体E可合成一种聚酯类高分子化合物F,由E合成图1F的反应类型为 ,该反应的化学方程式为 .(提示)第2页(共12页)(6)芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,写出G所有可能的结构简式 . 第3页(共12页)A.减小容器体积,平衡向右移动B.加入催化剂,Z的产率增大2013年全国统一高考化学试卷(大纲版)C.增大c(X),X的转化率增大参考答案与试题解析D.降低温度,Y的转化率增大 一、选择题【考点】CB:化学平衡的影响因素.菁优网版权所有1.下面有关发泡塑料饭盒的叙述,不正确的是( )【专题】51E:化学平衡专题.A.主要材质是高分子材料B.价廉、质轻、保温性能好【分析】A、反应前后气体体积不变,减小容器体积压强增大,平衡不变;C.适用于微波炉加热食品D.不适于盛放含油较多的食品B、催化剂改变反应速率,不改变化学平衡;C、两种反应物,增加一种物质的量增大另一种物质转化率,本身转化率减小;【考点】L3:常用合成高分子材料的化学成分及其性能.菁优网版权所有D、反应是放热反应,降温平衡正向进行;【专题】538:有机化合物的获得与应用.【解答】解:A、反应前后气体体积不变,减小容器体积压强增大,平衡不变,故A错误;【分析】发泡塑料饭盒是以聚苯乙烯树脂为原料,经过高温加热熔融后加发泡剂丁烷加工而成,B、催化剂改变反应速率,不改变化学平衡,Z的产率不变,故B错误;是高分子材料,价廉、质轻、保温性能好,不适于用于微波炉加热食品、不适于盛放含油较多C、两种反应物,增加一种物质的量增大另一种物质转化率,本身转化率减小,增大c(X),X的食品,据此即可解答.的转化率减小,故C错误;【解答】解:A.发泡塑料饭盒是以聚苯乙烯树脂为原料,加工而成是高分子材料,故A正确;D、反应是放热反应,降温平衡正向进行,Y的转化率增大,故D正确;B.发泡塑料有细微的独立气泡结构,有效降低空气对流导致的能量交换,是热的不良导体,传故选:D。导热的能力很差,能起到保温的作用,一般发泡塑料快餐盒5克左右,所以质量轻,价格也便【点评】本题考查了化学平衡的影响因素分析判断和化学平衡移动的理解应用,题目难度中等.宜,每个餐盒1角钱左右,故B正确; C.当使用一次性发泡塑料餐具盛装热食物或热开水时,通常温度超过摄氏65度以上,一次性发1218143.下列关于同温同压下的两种气体CO和N2的判断正确的是( )泡餐具中的所含的毒素就会析出,浸入食物,所以不能用微波炉加热食品,故C错误;A.体积相等时密度相等D.一次性发泡餐具中的聚苯乙烯高分子是有机物,根据结构相似相溶,盛放含油较多的食品是B.原子数相等时具有的中子数相等有机物,食品中会溶解苯乙烯单体,苯乙烯对人的神经中枢有害,所以不适于盛放含油较多的C.体积相等时具有的电子数相等食品,故D正确;D.质量相等时具有的质子数相等故选:C。【点评】本题主要考查了发泡塑料的使用,掌握发泡塑料的成分是解答本题的关键,平时注意相【考点】54:物质的量的相关计算.菁优网版权所有关知识的积累,题目较简单.【专题】518:阿伏加德罗常数和阿伏加德罗定律. 2.反应X(g)+Y(g)⇌2Z(g);△H<0,达到平衡时,下列说法正确的是( )第4页(共12页)2+2﹣【分析】同温同压下,气体的Vm相等,等体积时,根据n=可知气体的物质的量相等,结合原6Fe~Cr2O7,据此计算.【解答】解:A.Fe板作阳极,为活性电极,Fe失电子,发生氧化反应生成亚铁离子,阳极反应子的构成以及相关物理量的计算公式解答该题.为﹣═2+,故正确;121814Fe﹣2eFeA【解答】解:A.由于CO和N2的相对分子质量不等,故体积相等的两种气体的质量不等,2﹣2++3+3+B.由反应式Cr2O7+6Fe+14H═2Cr+6Fe+7H2O可知,处理过程中消耗氢离子,溶液的酸性因此密度不等,故A错误;减弱,溶液增大,故错误;121814pHBB.1个CO分子中有16个中子,1个N2分子中含有14个中子,二者均为双原子分子,原子C.阴极发生还原反应,溶液中的氢离子得到电子减少,同时生成氢氧根,有Fe(OH)3沉淀生数相等,即分子数相等,但中子数不等,故B错误;成,故正确;121814CC.CO和N2均为14电子分子,同温同压下,体积相等则分子数相等,所具有的电子数相D.Fe﹣2e﹣=Fe2+,则转移电子数12mol需要6molFe,再根据能够处理的关系式,得6Fe~12e﹣~等,故C正确;2+~2﹣,故被还原的2﹣的物质的量为,故正确;1218146FeCr2O7Cr2O71molDD.CO和N2分子内均有14个质子,由于二者的相对分子质量不等,故等质量的两种分子所故选:B。具有的质子数不等,故D错误。【点评】本题考查电解原理、氧化还原反应等,清楚发生的电极反应是解题的关键,是对学生综故选:C。合能力的考查,难度中等.【点评】本题考查基本概念和基本理论知识,意在考查考生对一些重要概念与理论的理解能力, 题目难度中等.5.下列操作不能达到目的是( ) 2﹣选项目的操作4.电解法处理酸性含铬废水(主要含有Cr2O7)时,以铁板作阴、阳极,处理过程中存在反应2﹣2++3+3+3+.配制将溶于蒸馏水中Cr2O7+6Fe+14H═2Cr+6Fe+7H2O,最后Cr以Cr(OH)3形式除去,下列说法不正确的A100mL1.0mol/L25gCuSO4•5H20100mL是( )CuSO4溶液﹣2+A.阳极反应为Fe﹣2e═FeB.除去KNO3中少量NaCl将混合物制成热的饱和溶液,冷却结晶,B.电解过程中溶液pH不会变化过滤C.过程中有Fe(OH)沉淀生成﹣3C.在溶液中将MnO4完全转向酸性KMnO4溶液中滴加H2O2溶液至紫2﹣D.电路中每转移12mol电子,最多有1molCr2O7被还原化为Mn2+色消失D.确定NaCl溶液中是否混有取少量溶液滴加CaCl2溶液,观察是否出【考点】DI:电解原理.菁优网版权所有Na2CO3现白色浑浊【专题】51I:电化学专题.A.AB.BC.CD.D【分析】A.Fe板作阳极,为活性电极,Fe失电子,发生氧化反应生成亚铁离子;2﹣2++3+3+B.由反应式Cr2O7+6Fe+14H═2Cr+6Fe+7H2O可知,处理过程中消耗氢离子;【考点】U5:化学实验方案的评价.菁优网版权所有C.阴极发生还原反应,溶液中的氢离子得到电子减少,同时生成氢氧根;【专题】25:实验评价题.D.Fe﹣2e﹣=Fe2+,则转移电子数12mol需要6molFe,再根据能够处理的关系式,得6Fe~12e﹣~第5页(共12页)【分析】A.25gCuSO
你可能还喜欢
购买VIP会员享超值特权
VIP专享免费下载,付费文档最高省50%
免费下载
付费折扣
身份标识
文档工具
限时7.4元/月购买VIP
相关推荐
-
2014年全国统一高考化学试卷(大纲版)(含解析版)
2023-10-26 21:13
 12页
12页 -
2011年全国统一高考化学试卷(新课标)(含解析版)
2023-10-26 21:13
 13页
13页 -
2020年全国统一高考化学试卷(新课标ⅰ)(原卷版)
2023-10-26 21:13
 4页
4页 -
2018年全国统一高考化学试卷(新课标ⅰ)(含解析版)
2023-10-26 21:13
 14页
14页 -
2013年全国统一高考化学试卷(新课标ⅰ)(含解析版)
2023-10-26 21:13
 16页
16页 -
2021年高考化学(福建卷)原卷版
2023-10-26 21:13
 5页
5页 -
2012年全国统一高考化学试卷(新课标)(含解析版)
2023-10-26 21:13
 15页
15页 -
2014年全国统一高考化学试卷(新课标ⅰ)(含解析版)
2023-10-26 21:13
 16页
16页


 U3
U3